按照传统,FDA会每年秋季都会更新一次人工智能数据库,目前,FDA数据库中共有950个设备。
截至2024年10月,还没有任何使用生成式人工智能或由大型语言模型驱动的设备获批。
几年前,人工智能和机器学习技术的监管环境几乎不存在。医疗设备的批准并未明确指出某项技术是否基于人工智能。这使得医疗专业人员、患者和其他利益相关者难以了解人工智能在医疗解决方案中的融合程度。发明者和开发者也受到严重阻碍,因为他们看不到新技术获得市场准入的明确途径。区分这些基于人工智能的技术至关重要,因为它们对用户和患者有着独特的考虑和影响。
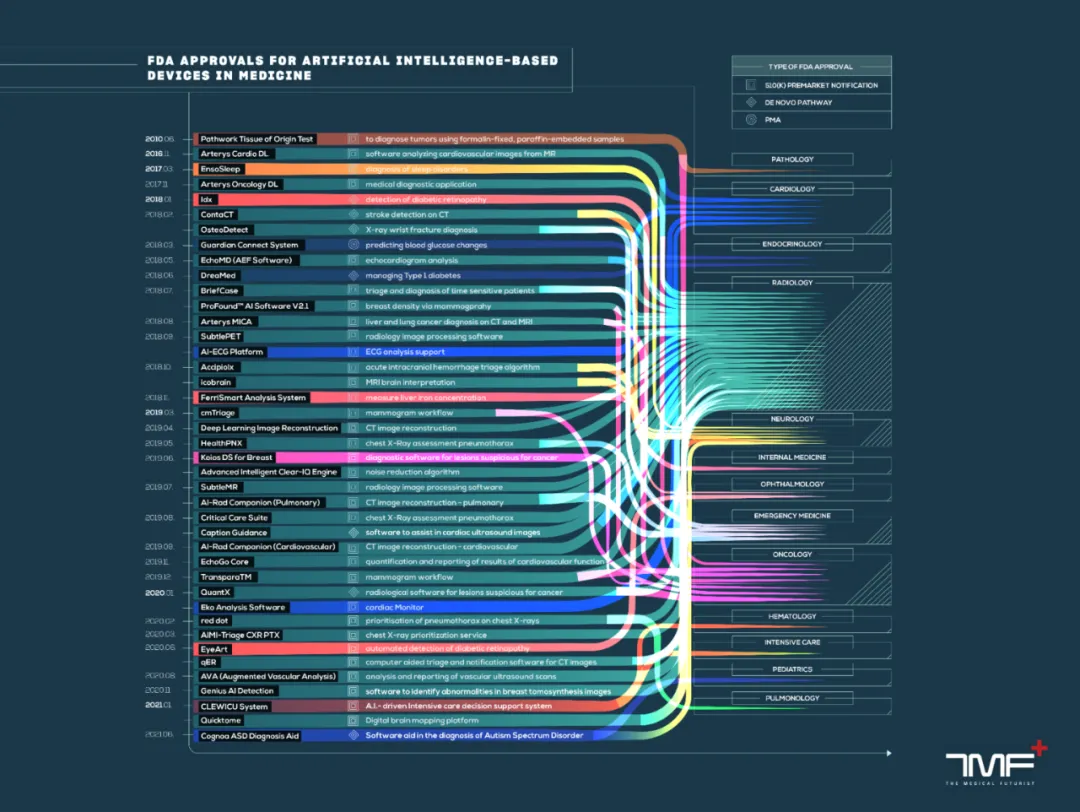
FDA多年来一直批准基于人工智能的设备,但最初并未将它们作为一个独特的类别加以区分。几年前,医学未来主义研究所(The Medical Futurist Institute)自行筛选所有这些审批项目,确定哪些是基于人工智能的设备,并创建了一个开放访问的数据库,与FDA共享。迄今为止,最新数据库显示共有950项获批,数字在急剧上升:
- 2017年,FDA批准了26个设备
- 2018年,64个设备
- 2019年,80个设备
- 2020年,113个设备
- 2021年,130个设备
- 2022年,158个设备
- 2023年,221个设备。
根据最新的数据分析,放射科是人工智能项目最多的医疗专科,拥有多达723个获批设备。排在第二位的是心脏病学或心血管(作为一个类别),有98个设备。除此之外,其他专业(神经学、血液学、胃肠病学-泌尿科学和眼科学等)只有少数几个设备。之所以呈现这样的现状,是由于深度学习在很大程度上由数据驱动的,在放射学领域找到了肥沃的土壤。
FDA批准基于人工智能的医疗设备↓

FDA的三种申报类型
FDA认可三种不同的提交类型:510(k)、上市前批准(PMA) 和De Novo途径。到目前为止,
- 510(k)是最受欢迎的,已有924项批准(比去年增加256项);
- De Novo途径有22项(增加1项);
- 上市前批准(PMA) 仅有4项(增加1项),远远落后。
510(k)之所以如此受欢迎,原因很简单:这是最简单的途径。因为它是应用于与其他合法上市设备实质等效的设备的审批流程,虽然公司需要证明其设备与已经获批的设备同样安全有效,但无需进行新的临床试验。
上市前批准(PMA) 是最严格的设备上市申请程序。它适用于高风险设备,要求制造商提供临床证据,证明设备的安全性和有效性。这通常涉及临床试验,因此成本高昂。
De Novo途径是一种监管途径,适用于中低风险的新器械,这些器械没有合法上市的先导器械。它适用于 I 类或 II 类(低风险分类)医疗器械。
根据人工智能支持的设备的获批数量,以下是一份企业排名:
- GE Healthcare:81项
- Siemens Healthineers:70项
- Philips:34项
- Canon:34项
- AIdoc:24项
- United Imaging Healthcare:21项
- RapidAI:15项
- Samsung Electronics:14项
- Nanox:11项
- Viz.ai:11项
文章来自于微信公众号“医疗科技高峰论坛”

发评论,每天都得现金奖励!超多礼品等你来拿
登录 后,在评论区留言并审核通过后,即可获得现金奖励,奖励规则可见: 查看奖励规则